Kẽm (Zn) là gì? Tính chất hóa học và tính chất vật lí của kẽm là gì? Cách điều chế như thế nào? Sẽ được ứng dụng như thế nào trong cuộc sống?
– Vậy thì ngay sau đây hãy cùng chúng tôi đi tìm hiểu về kẽm (Zn) này trong bài viết ngay sau đây nhé.
Xem ngay:

Kẽm (Zn) là gì?
+ Kẽm là một kim loại đã được phát hiện từ thời kỳ cổ đại. Các loại quặng kẽm đã được sử dụng để làm hợp kim đồng – kẽm là đồng thau vài thế kỷ trước khi phát hiện ra kẽm ở dạng nguyên tố riêng biệt. Đồng thau Palestin có từ thế kỷ 14 TCN đến thế kỷ 10 TCN chứa 23% kẽm.
- Kí hiệu: Zn
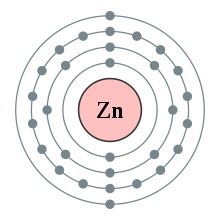
- Cấu hình electron: 1s22s22p63s23p63d194s2 hay [Ar]3d104s2
- Số hiệu nguyên tử: 30
- Khối lượng nguyên tử: 65g/ mol
- Vị trí trong bảng tuần hoàn
+ Ô: 30
+ Nhóm: IIB
+ Chu kì: 4
- Đồng vị: 64Zn, 65Zn, 67Zn, 68Zn và 70Zn
- Độ âm điện: 1,65
Tính chất vật lí
+ Kẽm là kim loại có màu lam nhạt, giòn ở nhiệt độ phòng, dẻo ở nhiệt độ 100 – 150ºC, giòn trở lại ở nhiệt dộ trên 200ºC. Kẽm có khối lượng riêng bằng 7,13 g/cm3, nóng chảy ở 419,50C và sôi ở 906ºC.
Nhận biết
+ Kim loại kẽm tan trong dung dịch NaOH, sinh ra khí không màu.
Zn + 2NaOH + 2H2O → Na2 [Zn(OH)4] + H2
Tính chất hóa học
+ Kẽm là kim loại hoạt động có tính khử mạnh Zn → Zn2+ + 2e
Tác dụng với phi kim
+ Zn tác dụng trực tiếp với nhiều phi kim.
2Zn + O2 → 2ZnO
Zn + Cl2 → ZnCl2
+ Ở điều kiện thường, Zn bị oxi hóa trong không khí hình thành lớp oxit bền bảo vệ ngăn không cho phản ứng tiếp tục xảy ra.
Tác dụng với axit
– Với các dung dịch axit HCl, H2SO4loãng:
Ví dụ: Zn + 2HCl → ZnCl2 + H2
Pt ion: Zn + 2H+ → Zn2+ + H2
(Zn khử ion H+ trong dung dịch axit thành hidro tự do).
– Với dung dịch HNO3, H2SO4 đặc:
Với các axit HNO3 đặc nóng, HNO3 loãng, H2SO4 đặc: Zn khử được N+5 và S+6 xuống những mức oxi hoá thấp hơn.
Zn + 4HNO3 đ → Zn(NO3)2 + 2NO2 + 2H2O
Tác dụng với H2O
– Phản ứng này hầu như không xảy ra vì trên bề mặt của kẽm có màng oxit bảo vệ.
Tác dụng với bazơ
– Kẽm tác dụng với dung dịch bazơ mạnh: NaOH, KOH, Ca(OH)2….
Zn + 2NaOH + 2H2O → Na2[Zn(OH)4] + H2
Trạng thái tự nhiên
+ Nguyên tố này thường tồn tại ở dạng hợp chất đi cùng với các nguyên tố kim loại thông thường khác như đồng và chì trong quặng. Sphalerit là một dạng kẽm sulfua, và là loại quặng chứa nhiều kẽm nhất với hàm lượng kẽm lên đến 60–62%.
+ Các loại khác khác có thể thu hồi được kẽm như smithsonit (kẽm cacbonat), hemimorphit (kẽm silicat), wurtzit (loại kẽm sulfua khác), và đôi khi là hydrozincit (kẽm cacbonat).
Điều chế kẽm (Zn)
+ Kẽm kim loại được sản xuất bằng luyện kim khai khoáng. Sau khi nghiền quặng, phương pháp tuyển nổi bọt được sử dụng để tách các khoáng dựa vào tính dính ướt khác nhau của chúng. Ở bước cuối cùng này thì kẽm chiếm 50%, phần còn lại là lưu huỳnh (32%), sắt (13%), và SiO2 (5%).
Công đoạn thiêu kết sẽ chuyển kẽm sulfua thành kẽm ôxít
2ZnS + 3O2 → 2ZnO + 2SO2
+ Sau đó, người ta có thể dùng 2 phương pháp cơ bản trong luyện kim là nhiệt luyện (pyrometallurgy) hoặc điện phân (electrowinning).
+ Quá trình nhiệt luyện khử kẽm ôxít với cacbon hoặc cacbon mônôxít ở 950 °C (1.740 °F) thành kim loại kẽm ở dạng hơi. Hơi kẽm được thu hồi trong bình ngưng. Quá trình được biểu diễn theo các phương trình dưới đây:
2ZnO + C → 2Zn + CO2
2ZnO + 2CO → 2Zn + 2CO2
+ Quá trình điện phân, tách kẽm từ quặng tinh bằng axít sulfuric.
ZnO + H2SO4 → ZnSO4 + H2O
Sau đó, người ta dùng phương pháp điện phân để sản xuất kẽm kim loại
2ZnSO4 + 2H2O → 2Zn + 2H2SO4 + O2
Ứng dụng
Kẽm là kim loại được sử dụng phổ biến hàng thứ tư sau sắt, nhôm, đồng tính theo lượng sản xuất hàng năm:
- Kẽm được sử dụng để mạ kim loại, chẳng hạn như thép để chống ăn rỉ.
- Kẽm được sử dụng trong các hợp kim như đồng thau, niken trắng, các loại que hàn, bạc Đức v.v. Đồng thau có ứng dụng rộng rãi nhờ độ cứng và sức kháng rỉ cao.
- Kẽm được sử dụng trong đúc khuôn, đặc biệt là trong công nghiệp ô tô.
- Kẽm dạng cuộn được sử dụng để làm vỏ pin.