Hydrazin (N2H4) là gì? Tính chất hóa học, tính chất vật lí của hydrazin sẽ có những gì? Ngay sau đây chúng ta hãy cùng đi tìm hiểu về Hydrazin (N2H4) trong bài viết sau đây nhé.
Xem ngay:
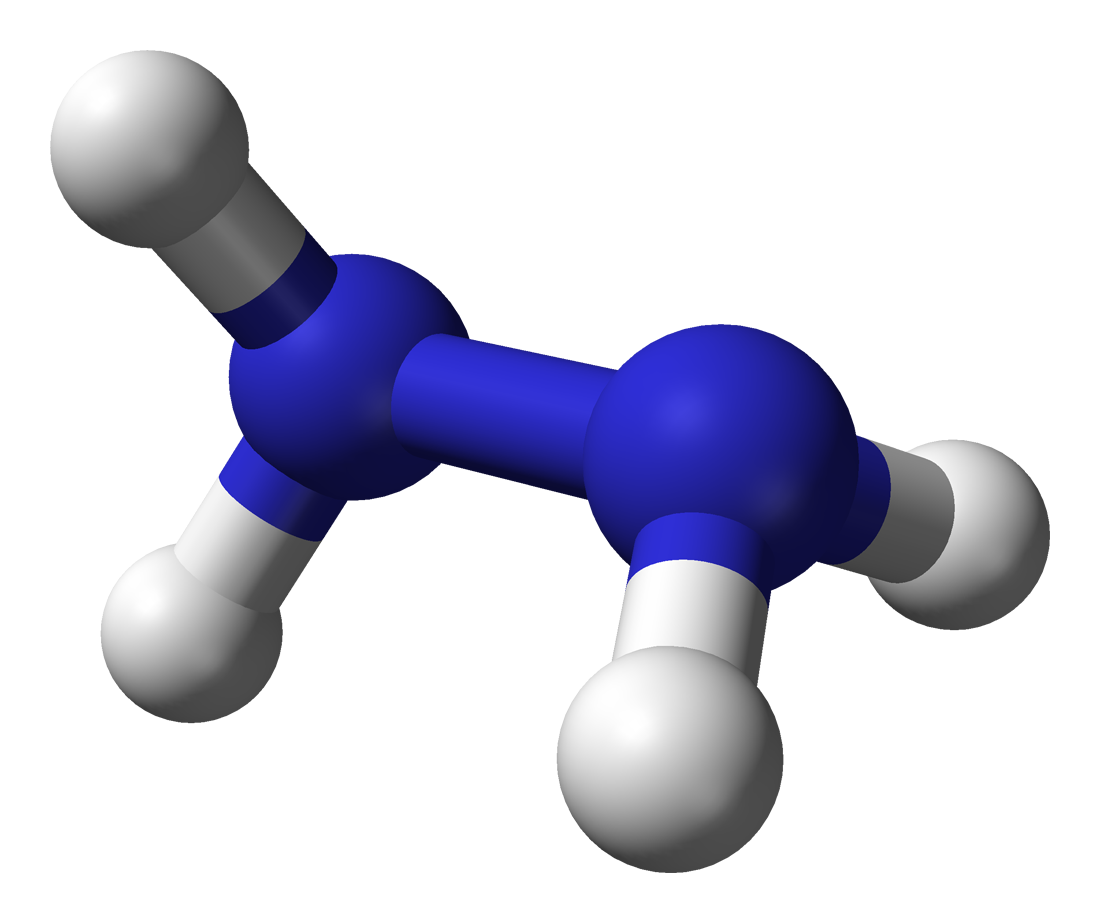
Hydrazin (N2H4) là gì?
– Hydrazin là một hợp chất lỏng chứa Carbohydrazide, không màu, có mùi hôi đặc biệt và có khả năng loại bỏ nhanh chóng oxy tự do ở trong tất cả các loại thiết bị nồi hơi dưới mọi áp lực, kể cả các bộ phận quá nhiệt không dẫn lưu.
– Một số tên gọi khác của Hydrazin: Hydrazin, hi dra zin hoặc, hydrazin hydrate (Tên tiếng Việt), Hydrazin hydrate, Tetrahydridodinitrogen, Diamine, Diazane, ( N – N ) hoặc diamidogen (Tên Tiếng Anh).
– Tên hoá học: Hydrazin hydrate.
Tính chất vật lí
- Hydrazine là chất lỏng không màu, nặng hơn nước và mùi khó chịu.
- Điểm đông: – 51,7 ℃
- Điểm nóng chảy: – 40 ℃ (274 K; 34 °F)
- Điểm sôi: 118,5 ℃ (387 K; 237 °F)
- Mật độ tương đối (nước = 1): 1.032 (21/4 ℃, 21 ℃ phương tiện hydrazine hydrate và 4 ℃ trong tỷ lệ mật độ nước)
- Áp lực hơi khí: 72,8 ℃
- Trọng lượng riêng: 1.03 (21 ℃)
- Khối lượng mol: 32,04376 g/mol
- Sức căng bề mặt (25 ℃): 74.0mN / m
- Chỉ số khúc xạ: 1,4284
- Nhiệt hình thành: – 242.71kJ/mol
- Điểm chớp cháy (mở cốc): 72,8 ℃
- Độ hòa tan: Trộn lẫn chất lỏng hydrazine hydrate với nước và ethanol sẽ tạo ra chất nhị trùng, không tan trong ether và chloroform.
- Ăn mòn: Đây là chất có thể ăn mòn thủy tinh, cao su, da, nút chai,….Khi ở trong không khí, nó có thể hấp thụ CO2 và tạo ra khói.
- Ổn định: ổn định ở nhiệt độ cao (khoảng 100 ℃) phân hủy thành N2, NH3 và H2
– Có tính kiềm mạnh và khả năng hút ẩm cao. Sản phẩm nguyên chất tồn tại ở dạng lỏng dạng dầu, không màu, trong suốt có mùi amoniac. Trong không khí ẩm ướt, hydrazine bốc khói mạnh.
– Nó và các dẫn xuất của mình được dùng như một chất khử, chất chống oxy hóa và cũng được sử dụng để uống thuốc.
– Có mật độ chất lỏng tương tự như nước.
Tính chất hóa học
– Là một hợp chất lỏng vô cơ, dễ cháy, không màu, có mùi khó chịu như amoniac. Cơ chế khử oxy của nó diễn ra theo nhiều phản ứng khác nhau:
Phản ứng với oxy tạo thành Nito, giúp hoạt động của lò hơi và tuabin được đảm bảo:
N2H4 + O2 -> N2 + 2H2O
Sau khi gia nhiệt lên đến trên 205°C trong lò hơi, nó sẽ bị phân hủy thành amoniac và làm tăng độ pH trong nước cấp, đồng thời làm giảm nguy cơ ăn mòn axit:
N2H4 + 2H2O + Heat -> NH3 + O2
Có phản ứng với lớp hematit ở trên các ống lò hơi, tạo thành một lớp magnetit ổn định và cứng, bảo vệ lò hơi không bị ăn mòn:
N2H4 + 6Fe2O3 -> 4Fe3O4 + N2 + H2O
Điều chế Hydrazin
Sản xuất Hydrazin với quy trình Olin – Raschig
- Được thực hiện lần đầu vào năm 1907 bởi nhà khoa học Đức Freidrich Raschig.
- Quy trình Olin – Raschig là sự hình thành của monochloramine và hypochiorite.
- Phản ứng giữa monochloramine và hypochiorite sẽ hình thành hydrazine.
- Quy trình Olin – Raschig sau đó được tối ưu hóa và được tập đoàn Olin dùng để sản xuất hydrazine khan, sử dụng trong ngành vũ trụ, hàng không.
Cụ thể quy trình Olin – Raschig diễn ra như sau:
+ Trộn dung dịch Clo với dung dịch xút lỏng trong hệ thống làm mát tuần hoàn với tỷ lệ mol 1 : 2 để để tạo ra monochloramine. Nhiệt độ phản ứng phải đảm bảo dưới 30°C và nồng độ xút lỏng phải dưới 1g/l.
NaOH + Cl2 -> NaOCl + HCl
Trộn NH3 với NaOCl theo tỷ lệ mol 3 : 1
+ Trộn thêm NH3 khan (dư khoảng 30 lần) vào hỗn hợp NaOH và NH2Cl, điều chỉnh nhiệt độ phản ứng từ 130 – 150°C, 2 – 3Mpa. Hydrazine sau khi được hình thành từ phản ứng này sẽ được chuyển sang bể chưng cất anilin để loại bỏ nước, thành dạng khan.
NaOH + NH2Cl + NH3 -> NH2-NH2.H2O + NaCl
Điều chế bằng quy trình Hoffman
– Quy trình này có tính kinh tế hơn quy trình Olin – Raschig, tránh được sự dư thừa amoniac. Tuy nhiên, cách này chỉ cho năng suất thấp và được sản xuất với quy mô nhỏ. Quy trình diễn ra như sau:
- Cho xút lỏng phản ứng với Clo để tạo thành Natri hypoclorit. Ure sẽ được dùng trong phản ứng ở thể lỏng sau khi đã hòa tan trong nước. Nhiệt độ phản ứng là khoảng 5°C. Một lượng keo có tỷ lệ 0,5g/mol sẽ được cho thêm vào để ức chế chất phản ứng.
- Hypochlorite và ure sau đó được cho vào lò phản ứng, tỷ lệ mol là 1 : 4 và nhiệt độ được tăng lên 100°C.
H2NCONH2 + NaOCl + 2NaCl -> N2H4 + NaCl + Na2CO3 + H2O
Quy trình Bayer giúp sản xuất Hydrazine
– Hydrazine được tổng hợp dựa trên phản ứng oxy hóa giữa natri hypochlorine và amoniac trong môi trường có aceton và nồng độ pH từ 12 – 14. Phản ứng bao gồm:
NaOCl + 2NH3 + 2CH3COCH3 -> (CH3)2C = N-N=C(CH3)2 + NaCl + 3H2O
(CH3)2C = N-N=C(CH3)2 + 2H2O -> 2CH3COCH3 + N2H4
Quy trình Peroxide
Quy trình diễn ra theo các bước sau:
Quá trình hình thành iminesau qua ngưng tụ:
Me(Et)C=O + NH3 -> Me(Et)C = NH + H2O
Quá trình oxy hóa imine thành oxaziridine:
Me(Et)C = NH + H2O2 -> Me(Et)CONH + H2O
Sự ngưng tụ oxaziridine với phân tử amoniac, hình thành hydrazone:
Me(Et)CONH + NH3 -> Me(Et)C = NNH2 + H2O
Hydrazone mang đi ngưng tụ với ketone thành azine:
Me(Et)C = O + Me(Et)C = NNH2 -> Me(Et)C = NN =C(Et)Me + H2O
Thủy phân azine tinh khiết:
Me(Et)C = NN =C(Et)Me + H2O -> Me(Et)C = O + N2H4
Ứng dụng
- Là tiền chất cho chất tạo khí.
- Dùng trong sản xuất natri azit, khí gas túi khí thông qua phản ứng natri nitrite.
- Sử dụng làm chất đẩy cho phương tiện vũ trụ, tên lửa.
- Dùng để giảm nồng độ oxy hòa tan phía kiểm soát độ pH nước nồi nấu công nghiệp.
- Là tiền chất thuốc trừ sâu, chế phẩm dược.
- Dùng trong tách kim loại quý, khai khoáng, thủy tinh, cao su,…