Axit pechloric (HClO4) là gì? Bạn có muốn tìm hiểu về Axit pechloric (HClO4) này hay không? Để có thể hiểu rõ hơn chúng ta hãy cùng đi tìm hiểu về Axit pechloric (HClO4) này trong bài viết sau đây nhé.
Xem thêm:
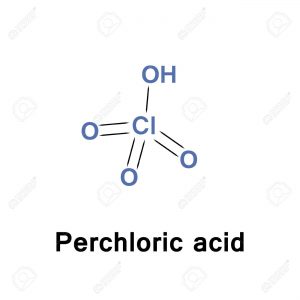
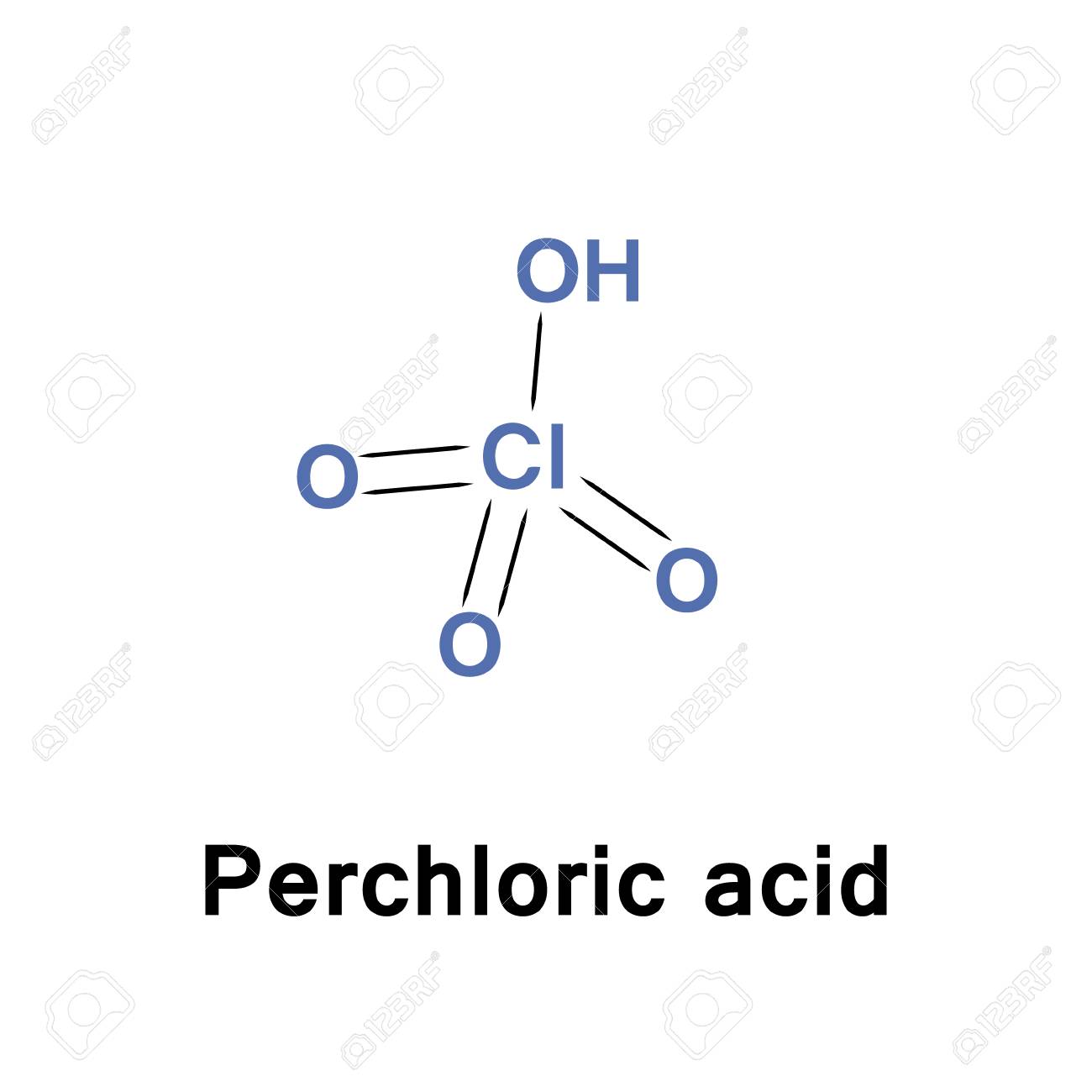
Axit pechloric (HClO4) là gì?
– HClO4 là công thức hóa học của một hợp chất vô cơ có tên axit pecloric. Nó thường ở dạng chất lỏng không màu và là một axit rất mạnh so với axit sulfuric hay axit nitric. Đồng thời nó cũng là một chất oxi hóa mạnh, rất dễ tan trong nước và dễ gây ra cháy nổ.
Tính chất vật lí của Axit pechloric
HClO4 là chất điện li mạnh hay yếu?
– Cùng với các axit như HCl, HNO3, H2SO4,… thì HClO4 cũng là một trong số những chất điện li mạnh. HClO4 là hợp chất rất dễ tan trong nước và tạo với nước các hidrat HClO4.nH2O (n=1,2,3).
HClO4 → H+ + ClO4–
- Khối lượng mol: 100,46 g/mol
- Bề ngoài chất lỏng không màu
- Khối lượng riêng: 1,67 g/cm3
- Điểm nóng chảy: -17 °C (hỗn hợp đẳng phí) và -112 °C (khan)
- Điểm sôi: 203 °C (hỗn hợp đẳng phí)[2]
- Độ hòa tan trong nước tan
- Độ axit (pKa) ≈ −8[3]
Tính chất hóa học của HClO4
– Phản ứng oxy hóa khử: tiến hành nhiệt phân HClO4 với sự tham gia của chất xúc tác là P2O5 cùng nhiệt độ tạo ra điclo heptoxit
2HClO4 → H2O + Cl2O7
– Phản ứng với nhiều chất khác như: PH3, NH2OH, HF, P2O5,…
PH3 + HClO4 → PH4ClO4
HClO4 + NH2OH → (NH3OH)ClO4
P2O5 + 6HClO4 → 3Cl2O7 + 2H3PO4
HClO4 + HF → H2O + ClO3F
KOH + HClO4 → H2O + KClO

Cách điều chế HCLO4
Điều chế trong công nghiệp
Axit pechloric được điều chế trong công nghiệp bằng hai cách.
Cho tác dụng natri peclorat với axit clohiđric tạo ra axit pecloric và kết tủa trắng natri clorua:
NaClO4 + HCl → NaCl + HClO4
Axit đặc có thể được tinh chế bằng cách chưng cất. Trực tiếp hơn và không sử dụng chất phản ứng là muối, tạo ra ôxi hóa anôt của dung dịch nước clo tại điện cực bạch kim.
Điều chế trong phòng thí nghiệm
– Phản ứng hóa học giữa bari peclorat với axit sulfuric tạo ra kết tủa bari sunfat và axit pecloric.
Ba(ClO4)2 + H2SO4 → BaSO4 + 2HClO4
– Ngoài ra, người ta cũng có thể điều chế axit pechloric bằng cách cho axit nitric tác dụng với amoni peclorat. Phản ứng này tạo ra nitơ ôxit và axit pechloric.
Ứng dụng của HCLO4
Ứng dụng công nghiệp
– Axit pechloric được điều chế hàng năm lên đến triệu tấn với công dụng chủ yếu để tạo ra amôni peclorat, chất này được sử dụng để chế tạo nhiên liệu tên lửa.
Ứng dụng trong hóa học
– Axit pechloric, là một trong những axit mạnh nhất theo. Vì thế không cần đến các muối phản ứng tiềm năng như sunfat hay clorit trong axit sunfuric và axit clohiđric.
– Mặc dù có khả năng cháy nổ cao khi sử dụng các muối peclorat, axit pechloric vẫn được chọn sử dụng trong nhiều sự tổng hợp. Vì lý do tương tự, axit cũng là một dung môi hữu ích trong sắc ký trao đổi ion.
– Axit pechloric cũng được sử dụng trong chạm, khắc lên bề mặt nhôm, môlybđen và một số kim loại khác.
Những lưu ý về HCLO4
Cảnh báo nguy hiểm
- H271: có thể gây cháy hoặc nổ, chất oxy há mạnh
- H290: có thể ăn mòn kim loại
- H302: có hại nếu nuốt phải
- H314: gây bỏng da nặng và tổn thương mắt
- H373: có thể gây tổn thương các cơ quan (tuyến giáp) nếu phơi nhiễm kéo dài hoặc lặp đi lặp lại
Lưu ý sử dụng và bảo quản an toàn
- Trang bị đầy đủ các trang thiết bị chuyên dụng khi tiếp xúc
- Tránh để trộn lẫn với những chất dễ cháy, hợp chất kim loại nặng hay axit hoặc kiềm
- Để tránh xa nguồn nhiệt
- Nếu có hiện tượng phơi nhiễm hay có băn khoăn, thắc mắc cần gọi ngay cho trung tâm chống độc hoặc bác sĩ để được giải đáp và có cách xử lý chính xác, kịp thời nhất.